BRAF是一种激活MAP激酶/ERK信号通路的丝氨酸/苏氨酸蛋白激酶,约50%的黑色素瘤携带激活的BRAF突变(BRAFV600MUT,包括V600E和V600K,前者超过90%)。随着PD-1/PD-L1和MAPK靶向治疗的出现,已经彻底改变了BRAFV600MUT黑色素瘤和其他疾病的治疗。然而这背后也存在着不容忽视的问题。
对于由BRAF抑制剂(BRAFi)和MEK抑制剂(MEKi)组成MAPK抑制剂(MAPKi),大多数BRAFV600MUT黑色素瘤患者的5年生存率低于30%,且在1年内出现获得性耐药。相反对于BRAF野生型(BRAFV600WTF)的黑色素瘤患者而言,BRAFi是禁忌,而MEKi单一疗法则由于先天或快速发展的耐药性导致疗效受限。同样的,在BRAFV600MUT或BRAFV600WTF黑色素瘤患者使用抗PD-1药物的免疫检查点治疗(ICT)仅可产生30%—40%的应答率。不过,值得庆幸的是,这些问题都在被慢慢发现和解决,1+1>2不是不可能。研究发现,当ICT与抗PD-1+抗CTLA-4药物联合使用时,可将先天性耐药率从60%-70%降至40%-50%。此外,近两年来的临床试验开始在BRAFV600MUT患者中同时启动抗PD-1/L1和BRAFi+MEKi治疗(也称为三联疗法),以此假设可以降低先天性抗PD-1/L1耐药性和获得性MAPKi耐药性。
尽管如此,对临床资料的回顾性分析表明,MAPKi的进展与后续抗PD-1治疗的不良反应有关,任何二线治疗与一线治疗的相同治疗相比结果均较差。是顺序上出了问题吗?那么是否可以先用ICT治疗,直到病情进展改变随后的MAPKi反应性呢?目前,有多个临床试验正在测试MAPKi与ICT的最佳顺序。这些试验采用方法主要是先测试一种治疗方法,至疾病进展后再转向另一种疗法,但是值得注意的是,这样的方式可能会引起交叉耐药性。因此,亟需对新的疗法进行临床评估,如在转换到另一种疗法或与另一种疗法结合之前,短时间接触一种疗法(以产生启动效应),理论上,这种顺序组合融合可以避免交叉耐药性的发展,通过叠加多种治疗作用机制提高耐药性演变的阈值,并允许一种治疗模式对另一种模式产生反应,从而产生协同效应。
2021年8月19日,来自美国加利福尼亚大学的Roger S. Lo团队在Cancer Cell上在线发表题为Anti-PD-1/L1 lead-in before MAPK inhibitor combination maximizes antitumor immunity and efficacy的文章,将体内临床前治疗试验与单免疫细胞和T细胞克隆型分析相结合,以确定与肿瘤生长和脑转移最持久控制相关的顺序组合治疗方案和细胞效应分子,发现在加入MAPK靶向治疗前短暂启动免疫检查点治疗可提高患者生存率。

2期随机临床试验S1320于2013年至2019年期间对BRAFV600E/KF转移性黑色素瘤患者进行随机分组,以比较BRAFi达拉非尼和MAPKi曲美替尼的间歇(n=101)和连续(n=105)给药的治疗疗效,同时以给药前先进行ICT为试验的一个随机分层因素。结果显示持续给药比间歇给药患者的无进展生存期(PFS)更长,在单变量中,给药前先进行ICT的患者的PFS更长。该试验表明率先进行ICT可增强黑色素瘤患者对MAPKi的反应。
与此同时,研究人员利用6个小鼠同基因皮下肿瘤模型(包括BrafV600、Nras或Nf1突变驱动的黑色素瘤以及KrasG12C驱动的结直肠癌和胰腺癌),测试了短暂的抗PD-L1(或抗PD-1)预处理(1周内两次)是否可以改善MEKi的后续反应,无论是否继续使用进行抗PD-L1治疗。研究结果发现,引入抗PD-L1后,再联合MEKi的治疗能够产生最强大的抗肿瘤活性,导致最广泛和持久的肿瘤消退,且该方案的结果与体重减轻无关,或者只与10%的体重减轻有关。而且抗PD-L1的治疗时间长短并不影响方案的疗效。由此可见,在抗PD-L1与MEKi联合使用之前给予短暂的抗PD-L1治疗即可以有效克服抗PD-L1先天性耐药,延迟获得性MEKi耐药。随后,研究人员对不同治疗方案下的三种肿瘤模型进行取样,收集细胞,采用质谱流式细胞技术(CyTOF,immune cytometry by time-of-flight)进行分析,以了解MEKi联合治疗前引入抗PD-L1方案所特异性引起的免疫细胞改变。结果发现虽然三种肿瘤模型在CD45+细胞浸润水平上高度不同,但是在所有治疗组的CD45+细胞中,肿瘤相关巨噬细胞(TAM)都是三种肿瘤模型中最丰富的亚群。同时,通过耦合的5'单细胞RNA测序(scRNA-seq)和T细胞受体测序(scTCR-seq)也在转录水平上证实了这一点,并且进一步分析表明MEKi联合使用之前引入抗PD-L1对治疗反应持久性的优化主要是通过促进巨噬细胞的促炎极化和干扰素γhi的克隆性扩增,以及高度表达活化基因的CD8+细胞毒性和增殖性(相对于CD4+调节性)T细胞实现的。
最后,由于黑色素瘤脑转移(MBM)对治疗的反应较低,研究人员测试了上述顺序联合方案对多器官转移的影响,结果显示在与MEKi联合使用之前,两剂量的抗PD-L1可以克服MBM中先天性抗PD-L1耐药性和获得性MEKi耐药性,而联合抗CTLA-4的ICT可以进一步促进抗PD-L1的启动作用,提高顺序联合方案的抗肿瘤活性和生存率。进一步通过TCR-seq跟踪分析瘤内(卵巢和脑肿瘤)T细胞克隆类型发现,由两剂抗PD-L1伴随MEKi联合的方案在每个器官的不同肿瘤累及区域之间以及颅内和颅外器官之间诱导了最强大的T细胞克隆扩增和克隆型融合,从而抑制了MBM,改善了小鼠存活率。
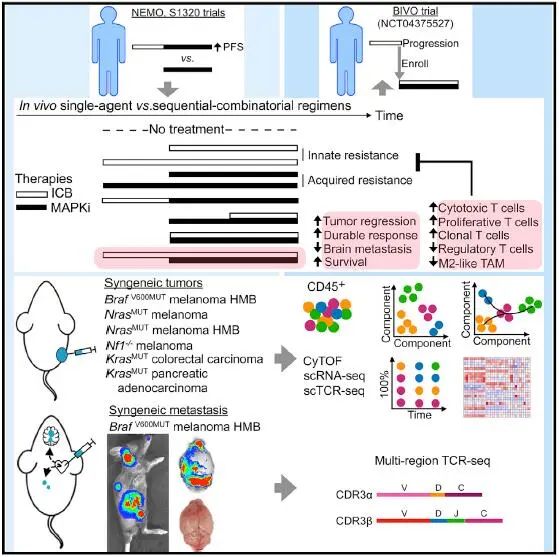
综上所述,本研究打破了传统联合用药的方式(同步进行),发现在MAPKi联合治疗前,仅两剂抗PD-1/L1(±两剂抗CTLA-4,无需进一步给药)即可最大限度地提高抗肿瘤免疫和疗效,抑制肿瘤耐药,改善生存率,由此为临床上抑制肿瘤治疗过程中的耐药提供了新的试验方案。
原文链接:
https://doi.org/10.1016/j.ccell.2021.07.023
如有侵权请联系删除 !





