肠道微生态及其产物的失调与炎症性肠病(IBD)等胃肠道疾病的发生发展紧密相关。然而,在庞大的肠道微生物基因库中,绝大部分基因及其产物的功能及活性尚未被解析,其极大地限制了我们对发病机制的理解以及新型肠道微生态制剂的开发。鉴于微生物组与人类肠道和免疫系统的长期共同进化关系,这些未知产物很有可能具有与健康相关的生物活性。这也强调了在完整微生态的条件下,体内微生物组生物活性与体外功能实验之间还存在巨大差距和未知。如何鉴定具有潜在生物活性的微生物基因产物成为一个亟待解决的问题。
2022年5月25日, 哈佛大学陈曾熙公共卫生学院Curtis Huttenhower教授领导的合作团队在Nature上发表了题为Discovery of bioactive microbial gene products in inflammatory bowel disease的研究论文(第一作者张艳聪博士),研发了一套崭新的鉴别具有潜在生物活性的微生物基因组产物的计算平台MetaWIBELE,系统地鉴别出大量未被报道的与IBD紧密相关的微生物蛋白质家族,极大地拓展了IBD微生物制剂研发的潜在靶点和策略。
首先,研发了一种崭新的计算方法- MetaWIBELE(https://huttenhower.sph.harvard.edu/metawibele/)来大规模鉴别微生物群落中具有潜在生物活性的基因产物。MetaWIBELE基于宏基因组拼接的蛋白家族,结合全局同源性、局部同源性以及非同源性等方法对其进行功能和系统分类解析,进而综合考虑蛋白家族的生态分布及其与环境或表型的统计相关性(例如与IBD的相关性)来预测其潜在的生物活性。作者利用MetaWIBELE对“整合人类微生物组计划”(iHMP2或者HMP2)的1,595宏基因组数据进行分析,鉴别出160万个蛋白家族,其中70%以上功能未被解析(即未表征蛋白),约45%的蛋白家族在现有数据库未找到显著同源蛋白(即新蛋白),它们代表了人类肠道微生物组的很大一部分未知功能。同时,作者基于表征和未表征蛋白的共丰度图谱,对42%的新蛋白进行了分类起源推断,极大地拓展了常见肠道菌群的泛基因组。
随后,鉴别出>340,000与IBD紧密相关的蛋白家族。这些蛋白家族在IBD病人的肠道炎症方面具有潜在的生物活性,其中一半以上的基因家族未被功能注释,表明了这些未知蛋白的潜在功能,极大地拓展了我们对于具有重要功能的微生物遗传物质的理解。同时,综合利用微生物多组数据,鉴别出的重要蛋白家族的潜在活性在宏转录组和宏蛋白组中得到验证。通过对具有功能注释的蛋白家族进行富集分析,作者发现具有较大生物活性潜力的蛋白主要富集到了高度特异的代谢过程或者多糖利用过程(无论来自于饮食或者宿主衍生)。作者通过系统地鉴定与炎症相关的蛋白家族的潜在活性,一方面证实了现有的机制假设,另一面也开辟了多种在人体肠道中具有治疗潜力的新途径。
最后,结合宏转录组数据、蛋白质二级和三级结构分析以及分子实验,对参与细胞间通讯的蛋白质子集进行了生物活性验证。作者发现了一种新型促炎肠杆菌科菌毛组分,其呈现出特异的免疫原性,极大地富集在了具有炎症的IBD病人中。相反,在没有炎症的对照组中,作者鉴别出一类新型的胞外类血管性血友病因子的同源蛋白,发现其在健康人体中,有助于维持拟杆菌生物膜在黏膜中的稳定性。
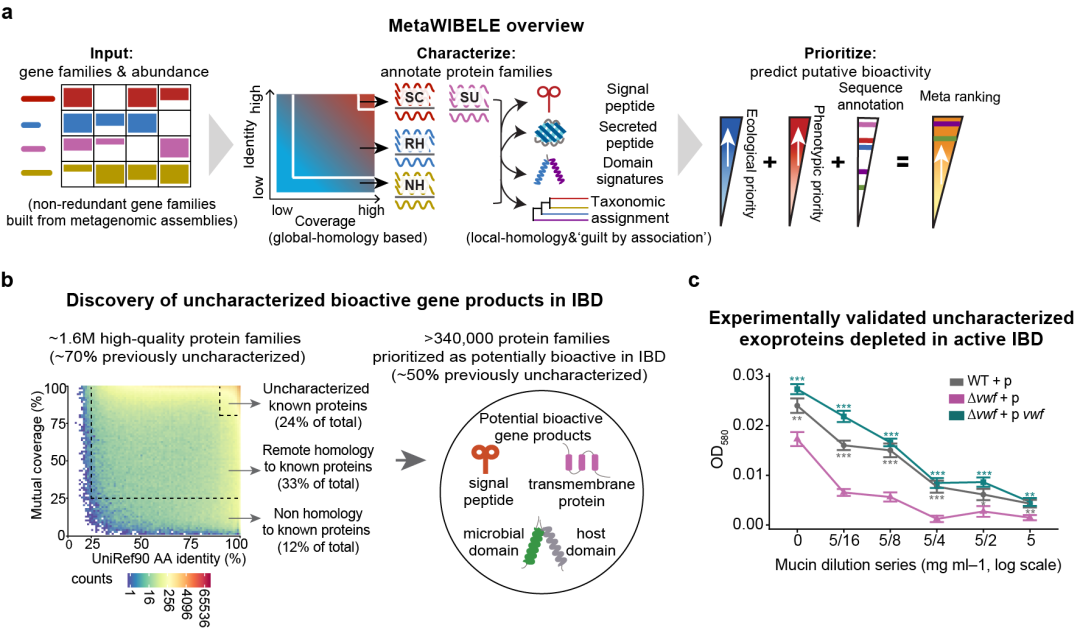
IBD微生物组中存在大量功能未被解析且具有潜在生物活性的蛋白家族
总的来说,该研究首次系统性地鉴别了人类微生物组中大量未被解析的基因及其产物,并评估了这些微生物基因产物在IBD中潜在的生物活性,为微生物制剂勘探和治疗先导靶向提供崭新思路。相关的新方法 - MetaWIBELE可适用于任何人类及环境微生物群落的研究,为探索各类微生物生态系统中未知蛋白功能提供了全新的研究思路。
原文链接:
https://doi.org/10.1038/s41586-022-04648-7
文章转自网络,如有侵权请联系删除。





