“代谢失衡”被长期认为是肿瘤的标志之一。具体来说,癌细胞可利用葡萄糖来促进有氧糖酵解以维持生存(称为“Warburg效应”)。在此类低葡萄糖、高乳酸的微环境中,T细胞难以发挥正常功能。对于Treg细胞来说,其在肿瘤微环境中会发生特定的代谢重编程。但其中还有诸多关键科学问题尚未阐明:肿瘤微环境内的代谢物如何直接作用于Treg细胞?Treg细胞是否具有特异的代谢检查点以响应特殊的代谢微环境?上述问题仍旧需系统探索。
近日,日本国家癌症研究中心Hiroyoshi Nishikawa教授课题组在Cancer Cell上在线发表题为Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments的研究论文,发现乳酸可在高度糖酵解的肿瘤微环境中诱导Treg细胞表达 PD-1,并发现MCT1在此过程中是重要的代谢检查点,为深入理解肿瘤微环境的代谢和免疫“平衡”提供了新的线索。

为了探索肿瘤的代谢特征与效应Treg细胞(Effector Treg cell, eTreg cell)的关联,研究者利用RNA-seq及流式细胞术对胃癌和非小细胞肺癌样本进行了深入研究,发现eTreg高浸润的肿瘤组织呈现糖酵解高代谢、MYC活化等特征。作者进一步发现,高糖酵解/MYC高表达的肿瘤组织呈现PD-1+eTreg细胞的高浸润,而PD-1+CD8+T细胞则反之低浸润,暗示肿瘤代谢物可能对eTreg细胞发挥功能起到特异的重要作用。鉴于乳酸是肿瘤糖酵解的终末产物,作者发现乳酸转运蛋白MCT1(Slc16a1)在PD-1+eTreg特异富集,而在CD8+T细胞中无此趋势。ChIP-seq表明,Treg细胞的特异转录因子FOXP3可直接与MCT1的DNA结合。这些结果均表明,乳酸可能对Treg细胞的功能及表型产生重要作用。
因此,研究者探索了eTreg细胞的乳酸代谢和PD-1表达的关联。乳酸梯度刺激表明,eTreg细胞的 PD-1 表达随着乳酸浓度的增加而显着升高,而CD8+T细胞却呈相反趋势。从机制上来说,作者认为Treg 细胞通过 MCT1 从微环境中摄取乳酸时,乳酸可能在Treg细胞中被代谢为磷酸烯醇丙酮酸(phosphoenol pyruvate, PEP),而磷酸烯醇丙酮酸正是T细胞的免疫代谢检查点。因此,研究者探索了乳酸浓度与磷酸烯醇丙酮酸的相关性,并发现乳酸可促eTreg磷酸烯醇丙酮酸增加,而在CD8+T细胞中无该趋势。作者进一步利用MCT1抑制剂以探索其与T细胞表型的关系,发现在高乳酸条件下eTreg 细胞的 PD-1 表达以浓度依赖性方式呈显著降低,且MCT1抑制剂可减少eTreg增殖、增强eTreg凋亡。这些结果表明,eTreg 细胞在高乳酸浓度下更具抑制性。在MCT1缺陷鼠中(Slc16a1 +/-小鼠),Treg细胞的PD-1表达显著降低。这些结果表明,高乳酸环境可使eTreg细胞利用MCT1摄取乳酸以上调PD-1,从而影响eTreg细胞的功能和表型。
最后,作者围绕“肿瘤和Treg细胞的交叉互作”这一科学问题进行了系统探索。首先,作者发现过表达MYC可在体外和体内产生更高水平的乳酸,并增加Treg细胞的PD-1表达;而敲低糖代谢关键酶LDHA的MYC过表达细胞可显著减少乳酸的产生并逆转Treg抑制表型,且这些结果在MC-38肠癌模型、B16黑色素瘤模型及肝转移模型中较为一致。进一步在体内抑制MCT1可降低微环境内Treg细胞的比例、抑制Treg细胞的PD-1表达,并增强了抗PD-1单抗的疗效。重要的是,MYC和糖代谢关键酶LDHA可在独立临床队列中预测胃癌、非小细胞肺癌、黑色素瘤患者的免疫治疗疗效,与患者的临床结局紧密相关。
综上,这项工作发现高度糖酵解的肿瘤可释放过量的乳酸,从而促Treg细胞通过MCT1摄取乳酸以增强PD-1表达,并重塑Treg细胞的功能及表型,而这可能是导致αPD-1免疫治疗产生耐药的原因之一。这项研究为设计新型免疫治疗策略提供了新的线索:靶向Treg细胞特异的免疫代谢检查点可能作为潜在的治疗策略。
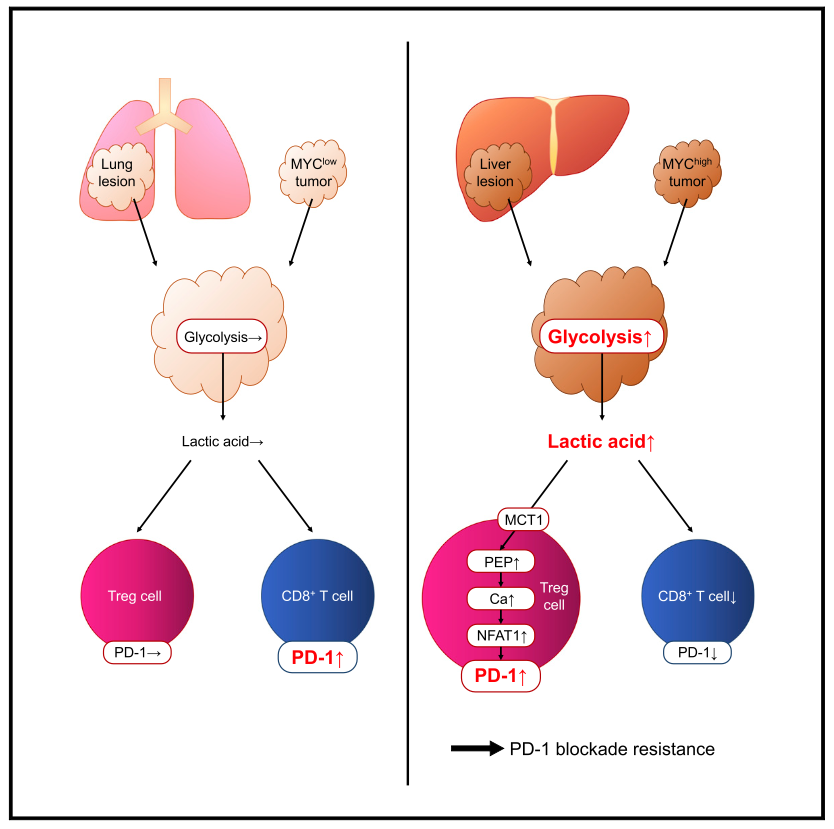
该研究主要发现:高度糖酵解的肿瘤可释放过量的乳酸,从而促Treg细胞通过MCT1摄取乳酸以增强PD-1表达,并重塑Treg细胞的功能及表型
转自网络,如有侵权请联系删除!





