肿瘤微环境(tumor microenvirment,TME)是指肿瘤细胞生存与扩散所处的内部环境,TME不仅包含肿瘤细胞本身、各种信号分子及细胞外基质,还包括与肿瘤细胞密切相关的免疫细胞、成纤维细胞和骨髓源性炎性细胞等。近年来,以免疫检查点阻断(immune checkpoint blockade,ICB)为代表肿瘤免疫疗法因其相对较小的副作用、较高的特异性及抑制复发等优点,成为肿瘤治疗与药物开发的新热点,相关基础和临床研究方兴未艾,突破性成果不断涌现。然而,超过一半的肿瘤患者经ICB治疗后病程无明显改善,解析影响ICB有效性的制约因素,并以此研发新的ICB治疗策略仍迫在眉睫。
程序性细胞死亡受体1(programmed cell death-1, PD-1)阻断是ICB肿瘤免疫疗法中最有代表性的治疗策略之一。正常生理状态下,PD-1与其配体PD-L1结合后能够通过下游信号抑制T细胞过度活化攻击正常细胞;但肿瘤细胞表面PD-L1表达异常上调,通过过度激活PD-1/PD-L1信号诱导T细胞耗竭,使肿瘤细胞发生免疫逃逸,导致肿瘤发展,患者病情恶化。而PD-1/PD-L1阻断疗法通过抑制PD-1/PD-L1信号而重新激活了肿瘤免疫微环境中的耗竭T细胞,恢复其对肿瘤细胞的杀伤功能,提高抗肿瘤免疫活性。包括CD8+T细胞在内的效应T细胞是执行抗肿瘤免疫功能的主力,而调节性T(Treg)细胞能够通过控制免疫系统的异常激活而维持免疫稳态,肿瘤免疫微环境中Treg细胞会抑制效应T细胞的功能,甚至抑制其抗肿瘤活性。因此,TME中CD8+T细胞和Treg细胞间的平衡对肿瘤免疫疗法的有效性至关重要。
近日,日本国立癌症研究中心Hiroyoshi Nishikawa教授领衔在Cancer Cell杂志发表了题为Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments的研究长文,通过从代谢角度研究TME中表达PD-1的效应T细胞和Treg细胞间稳态平衡的影响因素,发现乳酸能够作为Treg细胞的代谢检查点并控制TME中的免疫反应,影响PD-1阻断的效率。

首先,作者研究了TME中Treg细胞影响PD-1表达的因素。根据FOXP3和CD45RA的表达水平,作者将Treg细胞分为两类,即初始Treg细胞(CD45RA+CD25lowFOXP3lowCD4+)和效应调节性eTreg细胞(CD45RA–CD25highFOXP3highCD4+),而根据PD-1表达又将eTreg细胞分为PD-1higheTreg细胞和PD-1loweTreg细胞。不同肿瘤样本的RNA-seq分析发现PD-1higheTreg细胞中与糖酵解有关的基因及MYC靶基因表达上调,进一步验证后发现TME中肿瘤细胞的糖酵解活性与eTreg细胞中PD-1的表达存在正相关性。CD4+T细胞与CD8+T细胞比例是机体免疫状态的重要指标,而TME内CD8+T细胞PD-1的表达水平与CD4+eTreg细胞相比显著降低。
接下来,作者探究了eTreg细胞PD-1表达显著高于CD8+T细胞的调控机制。肿瘤细胞糖酵解的终产物为乳酸,而对肿瘤样本RNA-seq的富集分析发现PD-1+eTreg细胞中乳酸转运蛋白MCT1及其互作蛋白CD147表达异常上升,对ChIP-seq数据分析后发现FOXP3能够促进eTreg细胞中MCT1和CD147的表达。对eTreg细胞中乳酸与PD-1表达的关联性进行探究后,作者发现低葡萄糖状态下,乳酸能够诱导eTreg细胞PD-1的表达,并能促进eTreg细胞的增殖且抑制其凋亡,但乳酸对CD8+T细胞PD-1表达和增殖活性的调控与eTreg细胞相反。低葡萄糖高乳酸环境中,eTreg细胞内FOXP3的表达能够上调MCT1水平,继而促进乳酸的摄取,但乳酸对CD8+ T细胞不存在类似的诱导机制。
随后,作者发现PD-1阻断可以在低葡萄糖高乳酸环境下增强eTreg细胞的活性,导致对CD8+T细胞效应功能的抑制更强,表明乳酸富集诱导的eTreg细胞PD-1上调与PD-1阻断治疗失败间存在直接联系。PD-1higheTreg细胞中MYC基因表达上调,而在过表达MYC的肿瘤细胞系中,糖酵解水平及乳酸生成量上升。过表达MYC的肿瘤组织中CD8+T细胞数量及其表达的PD-1水平下降,但MYC过表达肿瘤组织中乳酸过量产生会特异性诱导eTreg细胞PD-1的表达,导致PD-1阻断中Treg细胞的免疫抑制性增强,诱导PD-1治疗中耐药性的产生。另一方面,抑制肿瘤细胞中乳酸脱氢酶A(LDHA)的表达或抑制TME中Treg细胞MCT1的表达会导致乳酸生成减少,进而使CD8+T细胞PD-1表达上升,eTreg细胞PD-1表达下调。抑制LDHA还会降低Treg细胞的免疫抑制功能,从而使PD-1阻断疗法的效率提高。对肝内肿瘤样本的体内实验也发现抑制肿瘤细胞或Treg细胞的乳酸代谢可以提高PD-1阻断疗法的效率。对多种类型肿瘤患者的队列分析发现肿瘤组织LDHA或MYC表达水平与无病进展生存期(Progression-Free Survival,PFS)长度呈负相关,通过糖酵解及乳酸代谢基因的表达可以预测临床肿瘤患者PD-1阻断疗法的有效性。
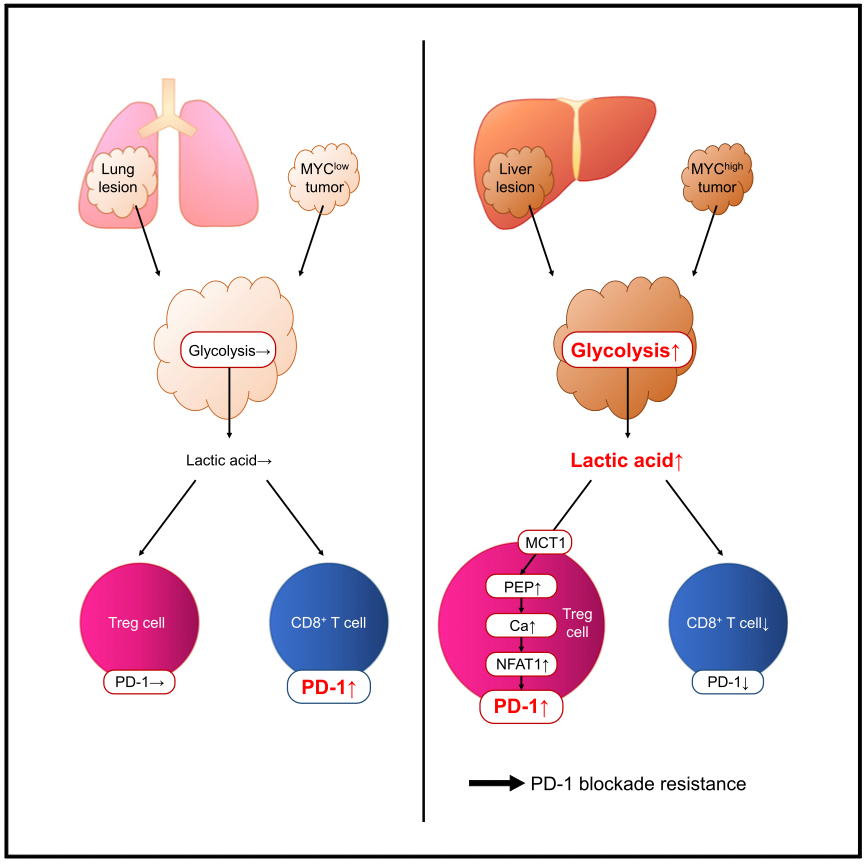
综上所述,本研究发现与效应T细胞相比,Treg细胞能够利用MCT1在糖酵解水平异常升高的肿瘤微环境中高效摄取乳酸,促进NFAT1入核并诱导Treg细胞表达PD-1,而效应T细胞PD-1的表达被抑制,导致了PD-1免疫阻断疗法的失效。本研究揭示了乳酸代谢影响肿瘤免疫微环境的新方式,为以乳酸代谢(如MCT1、LDHA)为靶标研发新的肿瘤免疫治疗策略提供了新的思路。
转自网络如有侵权请联系删除 !





