肾透明细胞癌(ccRCC)是肾癌中最常见的组织学亚型,全球发病率不断上升。ccRCC会发生自发消退,对IL-2和免疫检查点抑制剂(CPI)治疗有响应,所以是一种免疫原性较高的肿瘤类型,但肿瘤突变负荷(TMB)程度中等,与“冷”肿瘤相当。ccRCC中,TMB与CPI的响应性之间没有相关性。ccRCC富含移码插入和删除(fsINDELs),易产生新抗原,但fsINDELs负荷也不能用于预测ccRCC病人是否能从CPI治疗获益。PBRM1突变在60%的ccRCC中出现,有报道称PBRM1突变与CPI响应性之间具有相关性,但在不同研究中结论不一。
大规模肿瘤转录组分析显示,ccRCC是高度免疫浸润的实体瘤类型,但与其他肿瘤不同,高度的免疫浸润与肾切除术后较差的愈后相关。CPI治疗中,高T/低髓系细胞浸润和B细胞丰度高分别在anti-PD-L1和anti-PD-1响应患者中富集。然而,这些特征作为预测性生物标记物的交叉验证产生了不一致的结果,这可能是由于免疫肿瘤内异质性(ITH),尤其是因为先前的研究依赖于对单个肿瘤区域的评估。ITH是ccRCC的常见特征,与无定向扩散模式和术后结果相关。因此,找到针对ccRCC是否对CPI响应及相关预后的生物标志物,需要进一步进行研究。
近日,来自伦敦大学学院癌症研究所的Sergio A. Quezada和克里克研究所的Samra Turajlic在Cancer Cell杂志上发表文章Determinants of anti-PD-1 response and resistance in clear cell renal cell carcinoma,ADAPTeR II期临床试验招募15例转移性ccRCC病人接受nivolumab(anti-PD-1)治疗,取样115个多区域肿瘤样本,进行综合分析。基因组分析显示肿瘤的分子特征与响应性无相关性,但ccRCC特异性人内源性逆转录病毒的表达与临床响应间接相关。TCR分析揭示响应者在治疗前存在较高数量的已经扩增的TCR克隆,说明免疫反应的发生。治疗后,响应者倾向于扩增之前存在的类似的TCRs克隆,即抗原的加工和T细胞的存活都是针对相同的抗原。响应者中,nivolumab结合的CD8+ T发生扩增,表达GZMK/B。研究提示,nivolumab驱动治疗之前扩增的T细胞克隆的维持和替换,但只有维持是与治疗响应具有相关性。即维持和增强已经存在的免疫反应或是anti-PD-1发挥功效的关键因素。

ADAPTeR II期临床试验招募15例转移性ccRCC病人接受nivolumab(anti-PD-1)治疗,根据临床获益不同将病人分为“响应者”和“未响应者”。病人的年龄、性别、IMDC风险分类、存在肉瘤样/横纹肌样特征等都与是否响应无相关性。对样本进行全外显子测序分析,分子特征呈现典型的ccRCC特点,存在VHL突变(77%)(另外15%存在VHL甲基化)、PBRM1(62%)、SETD2(38%)、BAP1(15%)、KDM5C(38%)等突变。但这些基因突变与是否响应nivolumab没有相关性。wGII(染色体复杂性指标)、ITH、体细胞拷贝数改变等都与响应性没有相关性。之前研究显示,ccRCC肿瘤内细胞毒性T细胞的存在和对nivolumab的响应与人类内源性逆转录病毒(HERV)的表达具有相关性。研究人员重新整合分析了HERV的表达情况,发现之前报道的与细胞毒性T细胞出现、对CPI响应的HERV位点并未在响应者和未响应者之间差异表达,或受到免疫治疗影响。进一步分析发现,其中10个HERV可用于区分治疗前或治疗后的响应者和未响应者。这些HERV和LTR元件的转录是ccRCC高度特异性的,反映了肿瘤的纯度,且在无响应者治疗前过度表达,并与抗肿瘤免疫反应的缺失和anti-PD-1的无响应具有相关性。
差异化基因表达分析显示,无论是响应者,还是未响应者,nivolumab治疗都增加T细胞的浸润;相比于未响应者,响应者治疗后表达更高的CD3E、CD8A、GZMB和TCF7,且免疫激活和TCR信号通路在响应者中富集。对样本进行免疫化学和多重免疫荧光分析,发现T细胞数量、CD8+/Treg、CD4+/Treg、总PD-1表达等在响应者和未响应者中(治疗前和治疗后)无显著差异。治疗前,两组都表达较低的GZMB;但治疗后,总GZMB表达和CD8+ T细胞特异性GZMB表达在响应者中显著上升。随后,研究人员对治疗过程中T细胞克隆的扩增和替换进行分析,发现肿瘤样本中的TCR克隆性高于PBMCs,表明肿瘤内发生克隆扩增。响应者在治疗前具有更高的肿瘤内TCR克隆性,治疗后无显著差异。追踪TCR变化,治疗后响应者肿瘤内保留更多之前存在的TCR克隆。即先前存在的扩增的TCR克隆更容易在响应者的肿瘤内保留,而在未响应者中被替换。同样地,扩增的TCR克隆在治疗前和治疗后,其CDR3序列的聚类在响应者中有增加的趋势。
研究人员进一步在响应者和未响应者的肿瘤样本中分离了nivolumab结合的CD8+ T细胞,并进行高维流式分析、RNAseq和单细胞TCR-seq分析。Nivolumab结合的CD8+ T细胞上调促炎细胞/趋化因子和T细胞激活通路,无论是否有临床获益。响应者中观察到高度扩增的CD8+ 克隆,GZMK表达水平更高。Nivolumab结合的CD8+ T细胞与克隆性具有相关性,即Nivolumab结合导致克隆扩增。且响应者中,扩增的克隆成簇存在,大部分是药物结合,由预先存在的和新的TCR组成;而未响应者则整体上缺乏成簇的TCRs。最后,研究人员对已经发表的数据进行分析,验证了CPI响应者的CD8+ T细胞会发生TCRs扩增和GZMB/K上调。
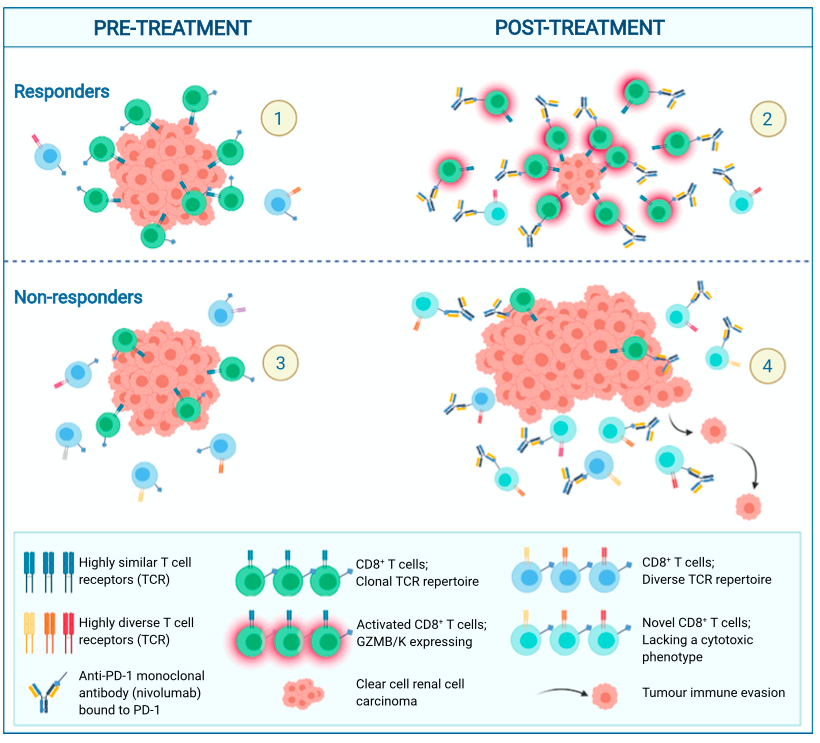
总的来说,研究对转移性肾透明细胞癌在anti-PD-1治疗前和后的基因组和肿瘤免疫微环境的特征进行了详细的描绘,揭示出患者对anti-PD-1有响应的决定性因素,或对ccRCC病人的精准医疗具有参考价值。
转自网络如有侵权请联系删除 !





