蛋白翻译中的缺陷导致蛋白质表达的变化,这些变化可能会成为癌症形成的驱动因素。NAD+是一种重要的代谢产物,通过作为氧化还原反应的辅助因子以及多聚核糖基化转移酶(poly(ADP-ribosyl),PARPs)和sirtuins乙酰化酶等的底物来调节多种细胞途径。NAD+的合成的和功能在细胞中具有区室化的特征,但是NAD+区室化以及其在癌症中的功能意义尚不清楚。
近日,美国德克萨斯西南医学中心W. Lee Kraus研究组发文题为Ribosome ADP-ribosylation inhibits translation and maintains proteostasis in cancers,发现在癌症细胞中核糖体单ADP -核糖基化的修饰会通过影响翻译过程并维持蛋白质稳定,为卵巢肿瘤等提供了新的治疗靶点。

在氧化还原反应中,NAD+被转化为还原形式的NADH。但是PARPs是通过切割ADP- ribose的部分并将其共价连接到特定底物蛋白质中的氨基酸来消耗NAD+。PARPs是细胞内NAD+的主要消耗者,其活性依赖于细胞对NAD+的补充能力。NAD+可以由ADP核糖基化反应的副产物烟酰胺通过回收途径重新合成。该途径中最后一步是由烟酰胺单核苷酸腺苷转移酶(Nicotinamide mononucleotide adenylyl transferases,NMNATs),不同的NMNATs具有特殊的亚细胞定位、不同的水平与功能。其中NMNAT-1定位在细胞核里;NMNAT-2定位在高尔基体,并在细胞质中发挥作用;而NMNAT-3根据不同的细胞种类而定位在线粒体或者细胞质之中。到目前为止,大多数研究都集中在了解主要由核PARP-1和PARP-2介导的多聚ADP-核糖基化修饰PARylation(简称PAR修饰)的生物学重要性,但对单核ADP-核糖基化修饰MARylation(简称MAR修饰)和催化这些反应的酶的生物学重要性知之甚少。因此,作者们希望揭开单ADP-核糖基化以及NAD+稳态调控在癌症生物学中的作用。
作者们发现在卵巢肿瘤中NMNATs具有非常独特的表达模式:与良性的卵巢组织相比卵巢肿瘤中NMNAT2的mRNA水平上调而NMNAT3的mRNA水平下调。为了检测NMNAT2敲低后对于NAD+的影响,作者们使用了遗传编码的NAD+的sensor对进行检验,发现NMNAT2敲低后会显著减低胞质中的NAD+但是提高细胞核中的NAD+。这些结果说明NMNAT-2对于卵巢肿瘤中细胞中的NAD+的胞质定位合成以及稳态非常关键。
NMNAT-2调节胞质中的NAD+的水平,因此作者们认为NMNAT-2可能对于卵巢肿瘤细胞胞质中的PARPs/MARTs的活性具有一定的支持作用。通过免疫荧光检测,作者们发现MAR最初定位在细胞质中,而PAR定位在细胞核中。而在NMNAT-2敲低后会显著降低胞质中的MAR水平但是不会影响到PAR水平。因此,这些结果说明NMNAT-2合成的NAD+会影响到卵巢肿瘤细胞中的MAR修饰。进一步地,作者们通过卵巢肿瘤病人的样本确认NMNAT-2与MAR水平之间存在显著的正相关,并且高水平的MAR修饰水平会导致无进展生存预后差。通过对核糖体蛋白修饰的检测,作者们发现其中大部分的蛋白均是被MAR修饰而非PAR修饰。同时,通过对NMNAT-2酶活性的破坏,作者们确认NMNAT-2酶活性对于核糖体蛋白的MAR修饰是非常关键的。
为了检测NMNAT-2对核糖体蛋白MAR修饰的调节作用对mRNA的翻译的影响,作者们使用嘌呤霉素摄取实验来测量卵巢肿瘤细胞中蛋白合成的水平。作者们发现对核糖体蛋白进行MAR修饰的NMNAT-2会通过以酶催化活性依赖的方式抑制蛋白合成。通过siRNA筛选鉴定,作者们发现涉及其中的PART-16是唯一影响核糖体蛋白MAR修饰的MART。PARP-16是一种尾部锚定在内质网的驻留蛋白,通过修改通路中的关键酶调控内质网应激反应。通过生化实验检测,作者们发现NMNAT-2与PARP-16在细胞中存在相互作用,但是该相互作用并不依赖于NMNAT-2的酶活性,NMNAT-2酶活性会影响PARP-16上的MAR修饰。因此,作者们的工作建立起了NMNAT-2与PARP-16之间通过NAD+产生的直接联系。
癌细胞需要高水平的蛋白质合成来支持它们的合成代谢过程,但高水平的蛋白质合成可能导致内质网应激,并导致有毒蛋白质聚集物的形成。考虑到PARP-16调节内质网,作者们对NMNAT-2与PARP-16敲除之后的蛋白质凝聚体的形成进行检测,发现通过敲除后会降低核糖体蛋白的MAR修饰并且会促进蛋白合成以及蛋白凝聚体的形成。 那么核糖体蛋白的MAR修饰是如何影响核糖功能以及抑制蛋白合成的呢?作者进行了多核糖体谱(Polysome profiling)的实验并在NMNAT-2或者PARP-16敲除后进行了多核糖体的RNA-seq检测,发现核糖体的承载量在敲除后出现了显著的增加。先前的研究的表明mRNA的非翻译区存在调控元件可以调节mRNA的翻译【5】。为此作者们对核糖体装载发生变化的mRNA进行分析后发现,这些mRNA的二级结构中包含茎环结构,正是这样的茎环结构的存在导致mRNA上核糖体的装载从而在NMNAT-2或者PARP-16敲除的情况下影响蛋白合成。
进一步地,通过在输卵管上皮细胞中进行异常的NMNAT-2过表达。作者们发现NMNAT-2过表达会提高蛋白的合成。另外,作者们对核糖体上MAR修饰的位点进行了鉴定。这些位点上MAR修饰的缺失会因为促进多核糖体的组装而促进蛋白质的合成。
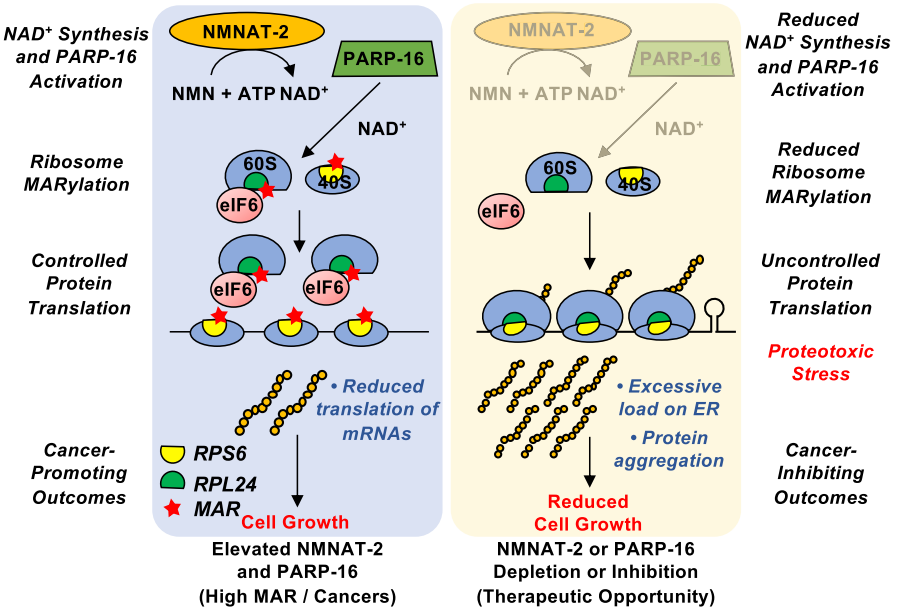
总得来说,该工作整合了细胞代谢、核糖体功能以及蛋白质稳态的具体分子途径,将NMNAT-2介导的胞质NAD+合成和PARP-16介导的胞质蛋白MAR修饰连接起来。核糖体MAR修饰通过调制蛋白质合成水平以及防止有毒蛋白质聚集,促进了癌症中的蛋白质稳态,这一机制的研究为卵巢肿瘤的研究和治疗提供了新的可能靶点。
原文链接: https://doi.org/10.1016/j.cell.2021.07.005
转自网络如有侵权请联系删除 !





