肠道菌群失调可导致许多人类疾病发生,包括1型糖尿病和2型糖尿病。肠道菌群与肠促胰素间关系密切,两者相互影响。肠促胰素效应减弱与 糖尿病的发生、发展密切相关。目前,基于肠促胰素效应研发的肠促胰素类降糖药物在2型糖尿病 的临床治疗中占重要地位。
肠道菌群受饮食、药物、年龄、性别等多种因素影响。肠道微生物群组成的变化则影响宿主的健康及其所患疾病的状态。很多与肠道菌群相关的主要代谢产物及其潜在生物学功能已被发现。肠道微生物失调可导致许多人类疾病发生,包括肥胖症和糖尿病。以肠道菌群为切入点来探索糖尿病发病的分子机制已成为研究新热点。动物和人体研究已发现,1型糖尿病宿主与非糖尿病宿主的肠道菌群结构显著不同。与对照组相比,1型糖尿病易感大鼠肠道内乳酸菌、布氏杆菌、双歧杆菌等数量显著减少,而类杆菌、真杆菌和瘤胃 球菌等 数量显著增多。人体研究也得到了类似的结果,在门水平,1型糖尿病患儿较健康儿童肠道内放线菌、厚壁菌的丰度显著减少,厚壁菌、拟杆菌的比例均显著降低;在属水平,1型糖尿病患儿肠道内以梭状芽孢杆菌、类杆菌和韦荣球菌为主,而健康儿童肠道内乳酸菌、双歧杆菌、球状布氏杆菌/直肠真杆菌和普氏杆菌的数量。1型糖尿病被认为是由先天性和适应性免疫诱导的β细胞介导的自身免疫性疾病。关于肠道菌群如何引发1型糖尿病的机制目前尚不完全明了。有研究结果提示,肠道菌群可能通过Toll样受体4(Toll-likereceptor4,TLR4)和髓样分化因子 (myeloid differentiation factor88,MyD88)途径 影响1型糖尿病的发生和发展。有研究结果也提示,肠道菌群可能通过改变肠道黏膜完整性导致1型糖尿病的发生。在糖尿病预防和预测(DIPP)研究中,新发1型糖尿病患者的肠道菌群组成与健康对照组显著不同。健康对照组有更多产生乳酸和丁酸的细菌可诱导黏蛋白合成,以维持肠道黏膜完整性; 而1型糖尿病组有更多利用乳酸产生非丁酸的细菌阻止黏蛋白合成,从而导致β细胞自身免疫损伤和1型糖尿病发生。但目前关于肠道菌群失调引发1型糖尿病的机制仍需要进行更多的研究来探讨。
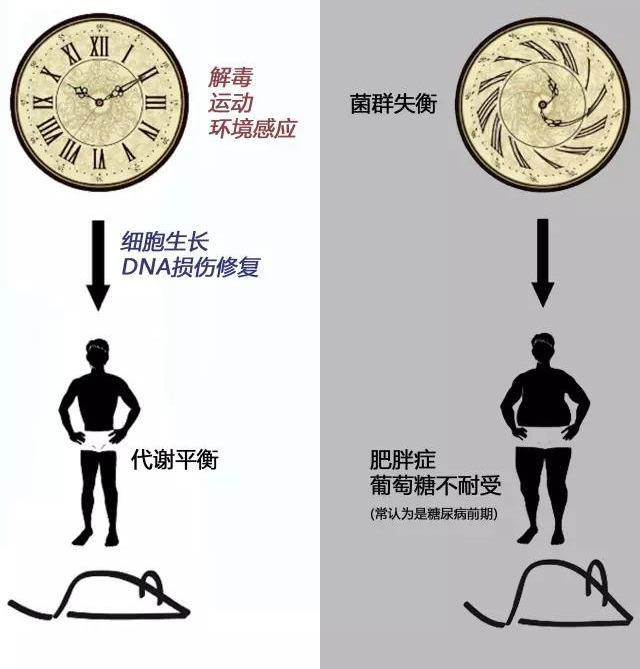
肠道菌群失调与肥胖、2型糖尿病的发生 、发展密切相关,其表现为肠道菌群丰度减少,拟杆菌门增多,厚壁菌门和细菌代谢产物丁酸盐减少等。来自人类和动物研究的证据表明,肠道菌群是介导减肥手术、饮食控制和降糖药物治疗效果的共同途径。肠道菌群参与2型糖尿病发生、发展的可能机制如下。① 产生短链脂肪酸( short -chainfattyacid, SCFA ) 和介导释放肠道激素。细菌发酵的主要产物是SCFA,除了作为能源物质或信号分子,通过与游离脂肪酸受体( free fatty acidreceptor ,FFAR)2和FFAR3结合,介导肠促胰素———胰高血糖素样肽1 ( glucagon - like peptide1,GLP- 1 ) 和 肽YY( peptideYY,PYY) 的释放。②调节胆汁酸代谢和影响肠道屏障功能。初级胆汁酸在回肠和结肠上段细菌的作用下形成次级胆汁酸。胆汁酸作为信号分子, 通过激活法尼醇X受体(farnesoid Xreceptor,FXR ) 等一系列调节,参与脂质和血糖代谢。此外,次级胆汁酸还可通过激活G蛋白偶联胆汁酸受体5(G protein -coupledreceptorforbileacids,TGR5),诱导肠道L细胞分泌GLP- 1, 促进棕色脂肪组织产热来增加能量消耗,可改善饮食诱导性肥胖。③破坏肠道免疫系统和引发组织慢性低度炎症,引起胰岛素抵抗。其中,肠道菌群通过介导肠促胰素参与能量平衡和葡萄糖稳态是重点内容。
肠促胰素是一 类肠源性激素,因其具有葡萄糖依赖的刺激胰岛素分泌的作用而得名。目前已发现的肠促胰素主要包括2种,即葡萄糖依赖性促胰岛素多肽 (glucose - dependentinsulinotropicpeptide,GIP)和GLP- 1。由胃肠道K细胞分泌的GIP和L细胞分泌的GLP-1均具有葡萄糖依赖的刺激胰岛素分泌的作用。肠促胰素效应减弱被发现与糖尿病的发生密切相关。目前,GLP-1受体激动剂作为肠促胰素类降糖药物在2型糖尿病的临床治疗中占重要地位。GLP-1受体广泛分布于全身多个器官或组织,包括胰腺、肾脏、心脏、血管内皮、胃肠道、肺、垂体、中枢神经系统等,故GLP-1具有多重生物学效应,其主要作用如下。①调节血糖稳态:GLP-1在胰岛可促进胰岛素合成和葡萄糖依赖性刺激胰岛素分泌。在高血糖状态下能抑制α细胞分泌胰升糖素,抑制肝糖输出,从而降低血糖水平。GLP- 1在胰腺外组织中可通过延缓胃排空、增加饱 腹感和降低食欲,来减轻体重,改善胰岛素抵抗,促进外周组织葡萄糖摄取。因此,GLP-1可通过胰内和胰外多种途径维持机体血糖稳态,来控制血糖水平。② 改善胰岛β细胞功能:GLP-1不仅可直接升高葡萄糖转运蛋白2和葡萄糖激酶水平,增强β细胞胰岛素分泌功能,还可促进β细胞增殖、新生,抑制β细胞凋亡,增加β细胞数量。此外,GLP-1还可通过降低血糖、游离脂肪酸水平,来减轻糖脂毒性,间接发挥对β细胞的保护作用。
肠道菌群失衡与糖代谢异常间的关系已被证实,但目前已发表的临床研究中,关于通过补充益生菌调节肠道菌群来预防和治疗糖尿病的研究结果却不尽理想。绝大部分研究结果提示,单纯补充益生菌并不能改善糖尿病或糖尿病前期患者的血糖水平,也不能降低糖尿病的发生风险。究其原因可能与研究设计有关,如选取的益生菌菌株、样本量较小、益生菌预的时间较短等;但益生元的使用仍有改善糖代谢异常的作用。因此,期待更大样本量、更长研究时间,以及严格设计的随机、安慰剂对照研究来进一步探讨益生菌对糖代谢的影响,评估益生菌与益生元对糖代谢影响的差异。此外,基于SCFA和肠促胰素是联结肠道菌群和能量代谢的关键物质,在益生菌菌株选择方面,应以此为机制选择能产生特定SCFA,以 及能以促进肠促胰素分泌为靶向的菌株。肠道菌群受饮食、药物、年龄、性别、遗传等多种因素影响,故益生菌治疗应综合考虑个体和菌群的特点,进行个性化的治疗。





